Du måste registrera dig och logga in för att kunna göra ett quiz, genomföra hela kursen samt för att kunna få ett diplom.
Markens kemiska egenskaper
I marken sker många kemiska reaktioner. Växtnäringsämnen löses upp från eller binds till mineralpartiklar och syra-basreaktioner påverkar markens pH, vilket i sin tur påverkar de kemiska formerna av näringsämnen och därmed ökar eller minskar deras växttillgänglighet. Utan dessa kemiska reaktioner skulle marken inte kunna förse våra grödor med den näring de behöver.
Berggrunden består av olika bergarter och bergarter består av olika mineraler. Mineraler är i sin tur uppbyggda av olika grundämnen som till exempel kisel, aluminium och kalium. Berg och mineral kan över tid brytas ner till mindre beståndsdelar med hjälp av vatten och temperaturskiftningar, en process som kallas för mekanisk vittring. På detta sätt uppstår lösa jordavlagringar som är en beståndsdel i marken. En annan typ av vittring är kemisk vittring. Den innebär att joner frigörs från mineralpartiklarna och löses upp i markvätskan. Det är på detta sätt marken kan förse växterna med näringsämnen.
Varje mineral har sin egen kemiska sammansättning. Markens egenskaper formas också således av mängden och kvaliteten av olika mineraler. På detta sätt påverkar mineralerna markbördigheten direkt. Den svenska berggrunden består huvudsakligen av sura bergarter, så vår mark är naturligt sur.
En molekyl är en grupp kovalent bundna atomer. Till exempel är vatten, eller H2O, en molekyl som består av två väteatomer (H) som är bundna till en syreatom (O).
En jon är en elektriskt laddad atom eller molekyl.
En katjon är en positivt laddad jon.
En anjon är en negativt laddad jon.
pH-värdet anger markens surhet. Ju fler vätejoner det finns i markvattnet, desto lägre är markens pH och desto surare är marken.
Mineralernas kemiska sammansättning avgör också vilka reaktioner som förekommer på mineralpartiklarnas ytor. De viktigaste reaktionerna i marken är näringsämnenas bindning till partiklarnas ytor. Typen och antalet ytor som binder näringsämnen, avgör markens förmåga att lagra näringsämnena från såväl mineralgödsel som organisk gödsel.
Jonbyte och markens pH
Växtnäringsämnena i marken som finns i jonform är antingen positivt eller negativt laddade beroende på vilket grundämne det rör sig om. De positivt laddade joner kallas för katjoner och de negativt laddade joner kallas för anjoner. Exempel på katjoner som finns i marken är kalcium (Ca2+), magnesium (Mg2+) och kalium (K+). Exempel på anjoner är nitrat (NO3–) och fosfat (PO43-), det vill säga jonformer av kväve och fosfor. De är alla viktiga näringsämnen för växter.
Markpartiklarna själva är också elektriskt laddade. I svenska jordar är de flesta mineralpartiklar negativt laddade eftersom de består av ungt jordmaterial. Organiskt material har både positiva och negativa laddningar, men fördelningen mellan dessa beror på markens pH. Ju lägre pH är desto mer dominerar de negativa laddningarna och ju högre pH är desto mer dominerar de positiva laddningarna.1
Genom elektrisk attraktion mellan jonernas och markpartiklarnas laddningar binds joner till markpartiklarnas ytor. Denna bindning är en relativt svag bindning och jonerna kan lätt frigöras från partiklarna och lösas upp i markvätskan. Detta kallas för att de är utbytbara joner. Markens förmåga att binda och avge näringsämnen på detta sätt kallas katjonbyteskapacitet om det gäller katjoner och anjonbyteskapacitet om det gäller anjoner. Av dessa är katjonbyteskapacitet av störst betydelse eftersom svenska jordar domineras av negativt laddade markpartiklar och de flesta växtnäringsämnen är katjoner. Ju större specifik yta som de samlade mineralpartiklarna i jorden har desto större förmåga har jorden att binda näringsämnen. Därför har jordar med högre lerhalt i regel en högre katjonbyteskapacitet. Även mängden organiskt material ökar katjonbyteskapaciteten, såväl som anjonbyteskapaciteten. En hög jonbyteskapacitet är eftersträvansvärt eftersom det innebär att marken har en god förmåga att leverera växtnäring till växternas rötter.
Växtrötternas upptag av näringsämnen är också ett jonbyte. När en växt ska ta upp en katjon, t.ex en kaliumjon (K+) byter den denna mot en annan katjon nämligen en vätejon (H+) som släpps ut ur roten. Vid upptag av en anjon, t.ex nitrat (NO3–) byter växten detta mot en hydroxidjon (OH–) som släpps ut ur roten.2 De näringsämnen som på detta sätt försvinner från markvätskan och markpartiklarnas ytor ersätts över tid genom vittring av markmineral och i åkerjordar även av tillförsel av växtnäringsämnen via gödsling och kalkning.2
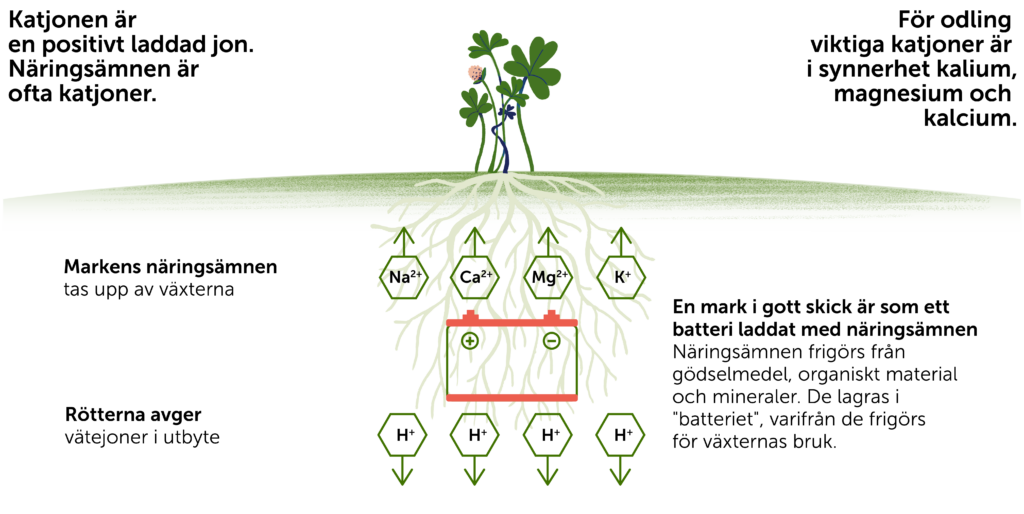
Katjonbyteskapaciteten hjälper oss att förstå markens pH och syra-basreaktionerna som styr pH. Markens pH är kanske den mest kända kemiska egenskapen i marken och är ett mått på koncentrationer av vätejoner i markvätskan. När marken försuras, ersätts näringskatjonerna (t.ex Ca2+ eller K+) på partikelytorna av vätejoner (H+). Då urlakas näringskatjonerna och kan inte längre användas av växterna. Detta kan ske på grund av naturliga processer som att kolsyra bildas av markrespirationen från markorganismer och respiration från växtrötter. Det kan också ske på grund av utsläpp av svavel och kväve från industri och fordonsavgaser. De naturliga processerna kompenseras vanligtvis över tid av kemisk vittring från mineralpartiklarna i jorden. I åkerjord kan vi också påverka pH genom att sprida kalk. Kalciumjonerna i kalken byter då ut vätejonerna i markvätskan via katjonbyte vilket leder till en ökning av pH.2
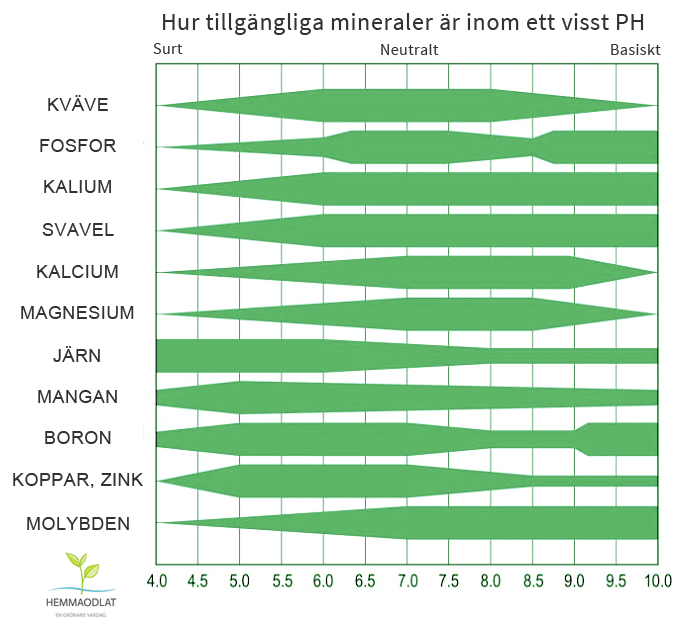
pH-värdet i marken påverkar såväl den biologiska aktiviteten i marken som växtnäringsämnenas löslighet. Vilket pH-värde som är lämpligt beror på vilka växter man vill odla och vilken jordart man har. Generellt bör pH-värdet på lättare mineraljordar (sand och mojord) ligga mellan 6,1-6,6 medan för lerjordar är motsvarande intervall 6,5-7,0.
Blir pH för lågt eller för högt påverkar det växtnäringstillgängligheten av olika grundämnen. Till exempel minskar tillgängligheten av kalium, svavel, kalcium och magnesium ju lägre markens pH är. Många mikronäringsämnen som mangan, järn, koppar och zink minskar däremot i tillgänglighet ju högre pH-värdet är.
Analys av markens kemiska egenskaper
pH-värdet i marken analyseras vanligtvis med hjälp av jordprover som skickas på laboratorieanalys, ofta i samband med markkarteringen. För ett snabbare resultat kan man också använda pH-remsor som finns tillgängliga i apotek och trädgårdsaffärer.
En del av markens kemiska bördighet undersöks med hjälp av markkartering. Till exempel kan man ta reda på jordarten samt koncentrationen av den växttillgängliga delen av näringsämnen som fosfor och kalium (P-AL och K-AL). Analys av katjonbyteskapaciteten ingår dock inte i den gängse markkarteringen.
I allmänhet bör grundanalysen i markkarteringen kompletteras med analys av mikronäringsämnen och mullhalt. Mullhalten bestäms utifrån en analys som kallas glödgningsförlust. Det är också möjligt att undersöka den totala mängden av fosfor och kalium i matjorden och alven (K-HCl och P-HCl). Är marken ny för dig bör du även göra en kartering av jordarten eller be den förre ägaren eller brukaren om den informationen. Kontakta Hushållningssällskapet i din region för råd om var man hitta tjänster för markkartering.

1 Eriksson J, Dahlin S, Nilsson I och Simonsson M. 2011. Marklära. Studentlitteratur AB, Lund.
2 Fogelfors, 2015. Vår mat – Odling av åker- och trädgårdsgrödor. Studentlitteratur.
3 Soinne, H., Kanerva, S., Hartikainen, H., Myllys, M., Palojärvi, A. & Alakukku, L. 2017. Maan happamuus on enemmän kuin pH. Käytännön Maamies 3/2017.
4 AGRIC 2021. Causes of soil acidity. Government of Western Australia. Department of Primary Industries and Regional Development. Agriculture and Food. https://www.agric.wa.gov.au/soil-acidity/causes-soil-acidity?page=0%2C1 Publicerat 17.9.2018. Hänvisat 12.11.2020.